PRACTICAS
Práctica de laboratorio para clases de reacciones químicas
- Introducción
- Fundamento teórico
- Materiales y reactivos
- Procedimiento
- Ecuaciones de los experimentos
- Resultados e informes
- Glosario de preguntas
- Conclusión
- Bibliografía
1. INTRODUCCIÓN
Este pequeño manuar es solo para dar a conocer un
universos basto, que posee la química. Por medio del
presente trabajo se quiere dar a conocer detalladamente las
diferentes clases de reacciones químicas por medio de la
practica o la experimentación, para así poder
establecer una relación entre los principios
teóricos y los hechos experimentales, lo cual nos
permitirá diferenciar los tipos de reacciones.
2. FUNDAMENTO TEÓRICO
2.1 REACCION QUÍMICA: Proceso en el que
una o más sustancias —los reactivos— se
transforman en otras sustancias diferentes —los productos
de la reacción. Un ejemplo de reacción
química es la formación de óxido de hierro
producida al reaccionar el oxígeno del aire con el hierro.
Los productos obtenidos a partir de ciertos tipos de reactivos
dependen de las condiciones bajo las que se da la reacción
química. No obstante, tras un estudio cuidadoso se
comprueba que, aunque los productos pueden variar según
cambien las condiciones, determinadas cantidades permanecen
constantes en cualquier reacción química. Estas
cantidades constantes, las magnitudes conservadas, incluyen el
número de cada tipo de átomo presente, la carga
eléctrica y la masa total. La importancia de dichas
reacciones es notoria en muchos aspectos de la vida diaria en
fenómenos tales como explosiones; procesos vitales tales
como alimentación, respiración etc. Todas las
sustancias que a diario utilizamos son o fueron producto de
reacciones químicas.
2.2 CLASES O TIPOS DE REACCIONES
QUÍMICAS:
2.2.1 REACCION DE COMPOSICIÓN O
SÍNTESIS: En las reacciones de síntesis o
composición es donde dos reactantes se combinan para
formar un solo producto. Muchos elementos reaccionan con otro de
esta manera para formar compuestos, por ejemplo:
2CaO(s) + 2H2O(l) → 2Ca(OH)2(ac)
en esta fórmula se mezclan 2 moles de oxido de
calcio sólido con 2 moles de agua líquida reacciona
produciendo 2 moles de dihidroxido de calcio acuoso.
2.2.2 REACCION DE DESCOMPOSICION O
ANÁLISIS: Este tipo de reacción es contraria a
la de composición o síntesis ya que en esta no se
unen 2 o más moléculas para formar una sola, sino
que una sola molécula se divide o se rompe para formar
varias moléculas mas sencillas, por ejemplo:
2HgO (s) → 2Hg(l) + O2(g)
en esta formula una 2 molécula de oxido de
mercurio sólido se descomponen o dividen para formar 2
moléculas de mercurio y una de oxigeno, las cuales son mas
sencillas que la primera.
2.2.3 REACCION DE DESPAZAMIENTO O SUTITUCION: En
este tipo de reacción, un elemento libre sustituye y
libera a otro elemento presente en un compuesto, su
ecuación general es:
CuSO4 + Fe → FeSO4 + Cu
En esta reacción un mol de sulfato de cobre con 1
mol de hierro para formar sulfato de hierro y cobre
2.2.4 REACCION DE DOBLE SUTITUCION O DOBLE
DESPLAZAMIENTO: Son aquellas reacciones que se dan por
intercambio de átomos entre los reactivos AB +
CD—————– AC + BD Por Ejemplo:
K2S + MgSO4 → K2SO4 + MgS
En esta reacción 1 mol de sulfuro de potasio
reaccionan con sulfato de magnesio para formar sulfato de potasio
y sulfuro de magnesio. Es difícil encontrar reacciones
inorgánicas comunes que puedan clasificarse correctamente
como de doble sustitución.
RESUMEN GENERAL DEL FUNDAMENTO
TEÓRICO

3. MATERIALES Y
REACTIVOS
Para la practica o experimentación de los
diferentes tipos de reacciones se utilizaron los siguientes
elementos:
3.1 REACTIVOS:
NH3
HCl
KClO3
NaCl
AgNO3
3.2 IMPLEMENTOS:
2 Pipetas
Pinzas de Crisol
Balanza
Regla
Mechero de Gas
Espátula
Tubos de Ensayo
Pinza con Nuez
Astilla De madera
Fósforo
4. PROCEDIMIENTO
4.1. COMBINACIÓN O
SÍNTESIS:
se tomo, con una pipeta una mínima cantidad
de NH3 . con otra pipeta se tomo una cantidad mínima
de Ácido Muriático. Unimos las pipetas de tal
manera que los reactivos o sustancias entren en contacto y
observamos que paso con esa reacción.
4.2. DESCOMPOSICIÓN:
se pesaron aproximadamente 1g de KClO3 y se
deposito en un tubo de ensayo seco;Se aseguro el tubo de ensayo con una pinza en un
soporte dejándolo un poco inclinado, calentamos
suavemente la mezcla con el mechero de gas, para ver si
salía oxigeno de la reacción se puso una
astilla al rojo vivo o en ignición.
4.3 DESPLAZAMIENTO:
colocamos aproximadamente 5 cm3 HCl en un tubo de
ensayo.Aseguramos el tubo de ensayo con una pinza en un
soporte dejándolo inclinado, le agregamos un poco
ZnOSe calienta el tubo de ensayo con la mezcla ponemos
un frasco en la boca del tubo para lograr atrapar el
hidrógeno gaseoso que se desprende de la
reacción.
4.4 DOBLE DESPLAZAMIENTO:
Tomamos un tobo de ensayo en el cual agregamos 20
cm3 de NaCl (Sal Común) diluido al 10%, agregamos
luego un poco de AgNO3 , y vemos que se forma un precipitado
que es una de las tantas cosas que indica que hubo una
reacción química.
5. ECUACIONES DE
LOS EXPERIMENTOS
5.1. COMBINACIÓN O SÍNTESIS: La
ecuación de la reacción de combinación o
síntesis del experimento realizado es la
siguiente:
NH3 + HCl → NH4Cl
Aquí comprobamos que esta es una reacción
de síntesis, ya que se combinan 2 sustancias y producen
una más compleja.
5.2. DESCOMPOSICIÓN: La ecuación de
la reacción de descomposición o análisis del
experimento realizado es la siguiente:
KClO3 → KCl + O2 ![]()
Aquí vemos que
se da el caso contrario al anterior ya que acá no se unen
varias formar 1 sustancia, sino que una se descompone o divide en
2 menos complejas, es decir, se presenta una reacción de
descomposición.
5.3 DESPLAZAMIENTO: La ecuación de la
reacción de desplazamiento o sustitución del
experimento realizado es la siguiente:
Zn + HCl → ZnCl + H2![]()
( En esta ecuación se presenta una
Reacción de sustitución o desplazamiento ya que
aquí los un átomo sustituye a otro en la otra
sustancia.
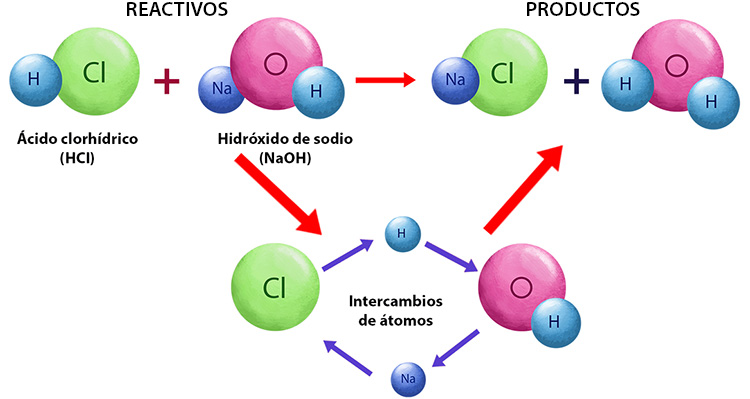
5.4 DOBLE DESPLAZAMIENTO O INTERCAMBIO: La
ecuación de la reacción de doble desplazamiento o
doble sustitución del experimento realizado es la
siguiente:
NaCl + AgNO3 → NaNO3 + AgCl
En esta ecuación vemos una Reacción de
doble sustitución o intercambio ya que se da un
intercambio de átomos entre los reactivos formando nuevos
compuestos.
RESULTADOS E INFORMES
6.1. TABLA DE RESULTADOS En la siguiente tabla se
encuentran ubicados los resultados de los
experimentos:
REACTANTES | DESCRIPCIÓN DE LA | PRODUCTOS | ||
NH3 + HCl | Cuando se pusieron en contacto los dos reactivos | NH4Cl | ||
KClO3 | Cuando se puso a calentar el KClO3 , este se | KCl + O2 | ||
Zn + HCl | Al calentar esta mezcla empezó a salir un | ZnCl + H2 | ||
NaCl + AgNO3 | Al hacer esta mezcla pudimos observar que se formo | NaNO3 + AgCl | ||
6.2 ¿ QUE MANIFESTACIÓN EN UN PROCESO
PUEDE INDICAR QUE ESTA SUCEDIENDO UNA REACCION O QUE DICHA
REACCION SUCEDIÓ?
R/ que en un cambio o reacción
química se altera la estructura y composición de la
materia, es decir de unas sustancias iniciales se transforman
otras, por lo cual para reconocer una si hay o hubo una
reacción química basta con observar ciertos
indicios como la formación de un precipitado, cambio de
color , sabor o la formación de un gas.
6.3. TABLA DE REACCIONES
REACCION | FORMA GENERAL | TIPO/REACCION | |
O2 + H2 → H2O | Elemento + Elemento → compuesto | Síntesis | |
S + O2 → SO2 | Elemento + Elemento →Compuesto | Síntesis | |
CuCO3 →CO2 + Cu | Compuesto → Compuesto + Elemento | Descomposición | |
MgCl + HSO4 → MgSO4 + HCl | Compuesto + Compuesto → Compuesto + | Doble Sustitución | |
Na + H2O → H2 + NaOH | Elemento + compuesto → Elemento + | Sustitución | |
REACCINES QUIMICAS
Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más especies quími...
- Una reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más especies



No hay comentarios.:
Publicar un comentario